Spike-and-wave - Spike-and-wave
Spike-and-wave è un modello dell'elettroencefalogramma (EEG) tipicamente osservato durante le crisi epilettiche . Una scarica a punta e onde è un modello EEG regolare, simmetrico e generalizzato visto in particolare durante l' epilessia di assenza , nota anche come epilessia "piccolo mal". I meccanismi di base alla base di questi modelli sono complessi e coinvolgono parte della corteccia cerebrale , la rete talamocorticale e meccanismi neuronali intrinseci.
Il primo modello a punte e onde è stato registrato all'inizio del XX secolo da Hans Berger . Molti aspetti del modello sono ancora oggetto di ricerca e scoperta, e molti aspetti sono ancora incerti. Il pattern spike-and-wave è più comunemente ricercato nell'epilessia con assenza, ma è comune in diverse epilessie come la sindrome di Lennox-Gastaut (LGS) e la sindrome di Ohtahara . I farmaci antiepilettici (AED) sono comunemente prescritti per il trattamento delle crisi epilettiche e se ne stanno scoprendo di nuovi con meno effetti avversi. Oggi, la maggior parte della ricerca è focalizzata sull'origine della scarica bilaterale generalizzata di picchi e onde. Una proposta suggerisce che un ciclo talamocorticale (TC) sia coinvolto nelle oscillazioni di picco e onda di inizio. Sebbene ci siano diverse teorie, l'uso di modelli animali ha fornito nuove informazioni sulla scarica di picchi e onde negli esseri umani.
Storia
La storia dell'epilessia generalizzata con crisi di assenza è datata al diciottesimo secolo, tuttavia l'inventore dell'elettroencefalogramma (EEG), Hans Berger , ha registrato il primo EEG di una crisi di assenza negli anni '20, che ha aperto la strada alla nozione generale di picco- e-elettrofisiologia delle onde. La sua prima registrazione di un EEG umano fu fatta nel 1924 usando un galvanometro, ma i suoi risultati erano molto grezzi e mostravano piccole oscillazioni indefinite. Ha continuato a perfezionare la sua tecnica e ad aumentare la sensibilità al galvanometro, in cui ha accumulato molti EEG di individui con e senza un malfunzionamento o disturbo cerebrale. Tra quelli testati c'erano pazienti con epilessia, demenza e tumori cerebrali. Hans Berger pubblicò le sue scoperte nel 1933, tuttavia i suoi risultati non fornirono una caratterizzazione definitiva del pattern EEG generale osservato durante una crisi epilettica. Nel 1935, FA Gibbs, H. Davis e WG Lennox fornirono una chiara descrizione degli schemi EEG spike-and-wave durante una crisi epilettica petit mal. Una registrazione intracellulare eseguita da DA Pollen nel 1964 ha rivelato che l'aspetto "picco" del fenomeno era associato all'attivazione neuronale e l'aspetto "onda" era associato all'iperpolarizzazione.
Fisiopatologia
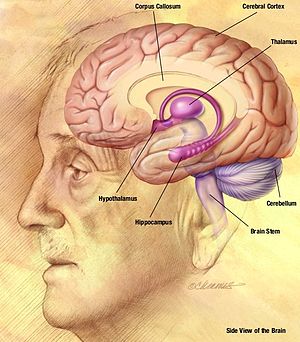
Lo schema a impulsi e onde osservato durante una crisi di assenza è il risultato di un'attivazione sincrona bilaterale di neuroni che vanno dalla neocorteccia (parte della corteccia cerebrale ) al talamo , lungo la rete talamocorticale. Il "picco" EEG del complesso picco-onda corrisponde alla depolarizzazione del potenziale di membrana neuronale, chiamato anche spostamento depolarizzante parossistico (PDS). La comprensione iniziale dietro il meccanismo del PDS era che era causato da un EPSP molto grande ( potenziale postsinaptico eccitatorio ) in assenza di inibizione sinaptica, che trasmetteva i potenziali d'azione nei neuroni innescando l'attivazione di canali voltaggio-dipendenti. I canali del sodio voltaggio-dipendenti causano una corrente di sodio transitoria nella cellula, che genera il potenziale d'azione . I canali del calcio voltaggio-dipendenti hanno anche qualche effetto sulla depolarizzazione della cellula, ma l'effetto è minimo rispetto ai canali del sodio. Tuttavia, la crescente concentrazione di calcio intracellulare porta ad una maggiore attivazione dei canali del potassio attivati dal calcio . Questi canali del potassio attivati dal calcio, insieme ai canali del potassio voltaggio-dipendenti , contribuiscono alla ripolarizzazione e all'iperpolarizzazione della membrana. In una crisi epilettica, ci sono periodi di depolarizzazione sostenuta, che causano un treno di potenziali d'azione seguiti da una fase di ripolarizzazione e iperpolarizzazione. Il treno dei potenziali d'azione costituisce la fase di "picco", e la ripolarizzazione e l'iperpolarizzazione costituiscono la fase di "onda".
Sebbene ci siano prove per la generazione di un grande EPSP, molti studi hanno dimostrato che l'inibizione sinaptica rimane funzionale durante la generazione di questi tipi di cambiamenti parossistici depolarizzanti. Inoltre, è stato dimostrato che una diminuzione dell'attività inibitoria non influenza l'accensione neocorticale. Pertanto, la teoria che l'attività spike-and-wave sia causata da un gigante EPSP a causa della diminuzione o dell'assenza di IPSP ( potenziali postsinaptici inibitori ) non è accettata come meccanismo generale per l'attività epilettica. Molti studi hanno dimostrato che la segnalazione postsinaptica inibitoria è effettivamente aumentata durante questi attacchi epilettici. L'attivazione di postsinaptico GABA A recettori porta ad un aumento della concentrazione di cloruro intracellulare, che in situazioni non epilettici porterebbe ad un IPSP. Tuttavia, negli spostamenti depolarizzanti correlati alle crisi, c'è una sostanziale attivazione dei recettori GABA A postsinaptici , che porta a una concentrazione ancora maggiore di concentrazione di cloruro intracellulare. Questo cambiamento nel gradiente di concentrazione di ioni fa sì che la corrente inibitoria del GABA A superi il potenziale di inversione , portando ad un efflusso degli ioni cloruro. Ciò porta a una diminuzione dell'ampiezza o addirittura a un'inversione di polarità degli IPSP.
I recettori metabotropici del glutammato ( mGluRs ) nella rete talamocorticale hanno anche dimostrato di avere un ruolo nella generazione di scariche di picco e onde (SWDs) associate all'epilessia con assenza. I diversi sottotipi di recettori mGlu hanno un ruolo modulatorio sulla trasmissione sinaptica sia eccitatoria che inibitoria. Ci sono ipotesi contrastanti per la funzione dei numerosi recettori mGlu per quanto riguarda le crisi epilettiche, tuttavia il ruolo del recettore mGlu4 è indiscusso nella generazione di SWD, mostrato in modelli animali. In uno studio, topi knockout privi di recettori mGlu4 hanno mostrato un'interruzione del rilascio di glutammato e GABA nella rete talamocorticale ed erano resistenti alle crisi di assenza indotte da basse dosi di pentilentetrazolo . Un altro studio ha mostrato che l'iniezione bilaterale di un antagonista del recettore mGlu4 nel nRT ( nucleo reticolare talamico ) di topi normali proteggeva dalle convulsioni indotte dal pentilentetrazolo. Inoltre, i ratti WAG/Rij mostrano un'aumentata espressione dei recettori mGlu4 nell'nRT rispetto a un gruppo di controllo di ratti normali. Questi studi mostrano che un aumento dell'espressione e/o dell'attività dei recettori mGlu4 è associato a scariche di picco e onde osservate nelle crisi di assenza. Questo legame tra i recettori mGlur4 e gli SWD ha portato alla ricerca di un antagonista selettivo del recettore mGlu4 (che bloccherà questi recettori) come potenziale nuovo farmaco per il trattamento dell'epilessia con assenza.
Fattori di inizio
L'uso di modelli animali, come i gatti, per studiare le scariche di picco e onde, ha fornito dati utili per lo studio dell'epilessia nell'uomo. Un metodo per indurre un attacco in un gatto è iniettare la penicillina nella regione corticale del cervello. Le scariche a punta e onde osservate nell'epilessia da penicillina generalizzata felina (FGPE) sono molto simili alle scariche a punta e onde di un attacco di assenza umana. L'uso dei ratti è stato anche un metodo comune per studiare il fenomeno delle punte e delle onde. I ratti genetici per l'epilessia dell'assenza di Strasburgo (GAERS) e i ratti consanguinei Wistar Albino Glaxo di Rijswijk (WAG/Rij) sono i due principali ceppi di ratti che sono stati utilizzati negli studi. I ratti di questi due ceppi mostrano crisi di assenza spontanee che consistono in una tipica attività di picchi e onde osservata su un EEG. I modelli genetici di ratto hanno fornito dati che mostrano che l'espressione delle crisi di assenza coinvolge sia la rete talamica che quella corticale. In entrambi i modelli, i dati elettrofisiologici hanno mostrato che i picchi e le onde vengono avviati nella corteccia somatosensoriale e quindi si diffondono rapidamente alla corteccia motoria e ai nuclei talamici. Utilizzando registrazioni intracellulari in vivo, è stato scoperto nel GAERS che i picchi e le onde vengono avviati nei neuroni dello strato 5/6 della corteccia somatosensoriale. Questi neuroni, mostrano un'iperattività distintiva associata a una depolarizzazione della membrana. Sono suggeriti per guidare l'infornamento delle cellule corticali distanti durante la scarica epilettica.
Un altro possibile modello di inizio testato nei ratti ha suggerito che il ciclo talamocorticale (TC) è coinvolto nell'inizio delle oscillazioni di picco e onda in determinate condizioni. In questo studio, i neuroni talamici relè e reticolari di ratti epilettici e non epilettici sono stati doppiamente registrati a livello extracellulare ed etichettati juxtacellularly. È stato osservato che oscillazioni medie (5-9 Hz) in entrambi i tipi di ratti si verificano casualmente in uno schema non sincronizzato nei neuroni relè e reticolari. Tuttavia, sono state osservate scariche spontanee di picchi e onde nei ratti epilettici quando le oscillazioni del mezzo si sono sincronizzate, suggerendo una dipendenza tra le due. Tuttavia, poiché le oscillazioni a medio raggio si sono sviluppate spontaneamente in scariche di picchi e onde, anche i fattori genetici sembrano contribuire all'inizio delle oscillazioni sincronizzate. Questi fattori genetici possono contribuire alle oscillazioni spike-and-wave diminuendo la soglia del potenziale d'azione nelle cellule reticolari, rendendole più eccitabili e potenzialmente più facili da avviare a fuoco sincronizzato. Un altro studio ha dimostrato che queste oscillazioni medie hanno portato a scariche di picchi e onde. L'attività delle regioni corticali primarie e secondarie, nonché della corteccia insulare adiacente è stata registrata utilizzando un EEG e applicata con stimolazione elettrica. I risultati qui hanno mostrato che l'inizio della scarica di picco e onda è stato seguito da oscillazioni di 5-9 Hz anche in queste regioni corticali.
Fattori genetici/di sviluppo
Elongator Protein Complex 4 ( ELP4 ) è stato identificato come un componente chiave nella trascrizione di geni noti per regolare il citoscheletro di actina , la motilità cellulare e la migrazione dei neuroni. La ricerca sulle ELP4 è stato collegato il gene per un centrotemporali picco tagliente fenotipo . Sono state fatte ipotesi che una mutazione nella regione non codificante del gene ELP4 possa interferire con l'interazione del gene elongo-mediata, in particolare durante le fasi di sviluppo della regione corticale. Questa mutazione può essere responsabile di una predisposizione alle scariche di picco e onde, così come di altri disturbi dello sviluppo neurologico.
Un altro studio ha rivelato che il glucosio può anche essere rilevante per il verificarsi di picchi e onde nei topi che contenevano un knock-in della mutazione umana GABA (A) γ2 (R43Q), che è noto per essere un fattore genetico coinvolto nella causa di assenza epilessia. Questi topi soggetti a crisi di assenza sono stati iniettati con insulina per abbassare i livelli di glucosio nel sangue del 40%. Questa riduzione della glicemia ha portato a raddoppiare il verificarsi di attività di picco e onde. Simile all'effetto dell'insulina, anche il digiuno notturno, in cui i livelli di glucosio nel sangue sono stati ridotti del 35%, ha mostrato questo doppio avvenimento. Questo modello conclude che bassi livelli di glucosio potrebbero essere un potenziale fattore scatenante per le crisi di assenza e potrebbero essere un fattore di rischio ambientale per l'uomo.
Spike-and-wave nell'epilessia
Assenza epilessia
Le raffiche di scariche a picco e onde generalizzate della durata di due secondi o più sono considerate crisi di assenza . Le crisi di assenza sono crisi epilettiche generalizzate che possono essere suddivise in due tipi, tipiche e atipiche. Le crisi di assenza tipiche e atipiche mostrano due diversi tipi di modelli di picchi e onde. Le tipiche crisi di assenza sono descritte da schemi di picchi e onde generalizzati su un EEG con una scarica di 2,5 Hz o superiore. Possono essere caratterizzati da un aumento della sincronizzazione delle scariche nel circuito talamocorticale. Possono anche essere caratterizzati dall'inizio acuto e dalla cessazione del sequestro. Le crisi di assenza atipiche hanno una frequenza maggiore nei bambini con epilessia grave che soffrono di più tipi di crisi. Lo schema a punte e onde visto qui è più irregolare dello schema generalizzato e sembra anche essere più lento. Questo schema irregolare è dovuto a scariche non sincrone del circuito talamocorticale. L'inizio e la fine di queste crisi di assenza atipiche sembrano essere meno acuti delle tipiche crisi di assenza.
Sindrome di Lennox-Gastaut
Le encefalopatie epilettiche sono un gruppo di condizioni che provocano il deterioramento delle funzioni sensoriali, cognitive e motorie a causa di un'attività epilettica costante. La sindrome di Lennox-Gastaut (LGS) è un'encefalopatia epilettica infantile caratterizzata da convulsioni generalizzate e lenta attività picco-onda durante la veglia. LGS è una combinazione di assenze atoniche, crisi toniche, deterioramento cognitivo e lenta attività picco-onda nell'EEG. Questa sindrome di solito deriva da un danno cerebrale focale, multifocale o diffuso e può essere suddivisa in tipi sintomatici e criptogenetici. Il deterioramento cognitivo con attività picco-onda ad alta frequenza colpisce la maggior parte dei pazienti di età compresa tra 2 e 9 anni con convulsioni generalizzate. L'età di esordio della LGS è compresa tra 1 e 10 anni, tra 2 e 6 anni per i casi sintomatici e tra 5 e 8 anni per i casi criptogenetici. Gli episodi possono essere innescati da modifiche del trattamento, che di solito coinvolge le benzodiazepine, o da cambiamenti nelle condizioni di vita.
Sindrome di Ohtahara
La sindrome di Ohtahara (OS), nota anche come encefalopatia epilettica infantile precoce (EIEE) con burst di soppressione (SB), è l'encefalopatia epilettica più grave e a sviluppo più precoce nei bambini. Questa sindrome è caratterizzata su un EEG da scoppi ad alto voltaggio e onde lente mescolate a picchi multifocali alternati a fasi di soppressione quasi piatte. L'SB inizierà gradualmente a ridursi a 3 mesi e scomparirà entro 6 mesi. OS passerà alla sindrome di West o LGS con l'età. Gli spasmi tonici sono le principali crisi convulsive osservate nella OS. A differenza di LGS, il modello di picco e onda è coerente sia durante la veglia che durante il sonno. I sintomi del sistema operativo includono:
- Difetti genetici
- Malattia mitocondriale
- Difetti della catena respiratoria mitocondriale
- Errori congeniti del metabolismo
- Encefalopatia da glicina
- Malformazioni corticali
- Asimmetria cerebrale
- Anomalie della fossa posteriore
- Agenesia dei corpi mammillari
- Frequenti crisi epilettiche generalizzate minori
- Anomalie EEG epilettiche gravi e continue
- Prognosi psicomotoria grave
Schema a punte e onde durante il sonno
Nella sindrome a punta e onda continua (CSWS), una forma rara di epilessia legata all'età, i bambini di età compresa tra tre e sette anni mostrano scariche continue a punta e onde durante il sonno lento. Questo disturbo si trova nello 0,2-0,5% di tutti i casi di epilessia infantile. Le scariche di questo disturbo raramente provocano crisi di assenza, ma nella CSWS sono state riscontrate compromissione motoria e regressione neurofisiologica. L'attività di picco e onda occupa circa l'85% del sonno con movimento oculare non rapido . Neanche questo schema continuo durante il sonno, come altri aspetti dell'attività di picco e onde, è stato completamente compreso. Tuttavia, ciò che si ipotizza è che la rete neuronale corticotalamica coinvolta negli schemi del sonno oscillante possa iniziare a funzionare come una fonte di scarica patologica.
Rilevanza clinica
La ricorrenza dopo una crisi solitaria non provocata nei bambini è di circa il 50%, quindi l'uso di farmaci antiepilettici (AED) è molto diffuso. I DAE mirano a rallentare il fuoco in eccesso, associato a scariche di picco e onde, all'inizio delle crisi. Possono provocare gravi reazioni avverse ai farmaci, quindi i medici devono essere consapevoli della sicurezza e dell'ammissibilità di ciascun farmaco. Questi effetti avversi sono una delle principali fonti di disabilità, morbilità e mortalità. Alcuni degli effetti avversi, come gli eventi cutanei, ematologici ed epatici gravi , di solito richiedono l'astinenza nei bambini e gravano pesantemente sui costi dell'assistenza sanitaria.
Il bromuro è stato introdotto come primo farmaco antiepilettico 150 anni fa. A causa degli effetti avversi sopra menzionati, il bromuro non è attualmente utilizzato come DAE. L'interruzione precoce del trattamento si è verificata troppo frequentemente e alla fine ha avuto effetti negativi su diversi pazienti. Le attuali opzioni di trattamento includono fenitoina , acido valproico , etosuccimide e i nuovi farmaci antiepilettici. Negli ultimi 20 anni sono stati introdotti al pubblico 15 nuovi farmaci antiepilettici con esiti positivi. Questi nuovi farmaci antiepilettici mirano a migliorare il rapporto costi-benefici nella terapia con antiepilettici, migliorare i profili di tollerabilità e ridurre il potenziale di interazione farmacologica. Nonostante questi importanti progressi, c'è sempre spazio per miglioramenti, soprattutto per quanto riguarda il trattamento su misura delle persone che hanno subito effetti avversi da vecchi AED.