Malattia emorragica del coniglio - Rabbit hemorrhagic disease
| Virus della malattia emorragica del coniglio | |
|---|---|
|
|
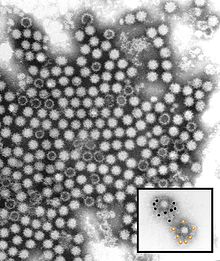
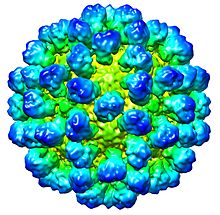
| Ricostruzione CryoEM del capside virale . EMDB entry EMD-1933 | |
|
Classificazione dei virus |
|
| (non classificato): | Virus |
| regno : | riboviria |
| Regno: | Orthornavirae |
| Filo: | Pisuviricota |
| Classe: | Pisoniviriceti |
| Ordine: | Picornavirales |
| Famiglia: | Caliciviridae |
| Genere: | Lagovirus |
| Specie: |
Virus della malattia emorragica del coniglio
|
| isolati | |
|
|
| Sinonimi | |
|
|
La malattia emorragica del coniglio ( RHD ), nota anche come malattia emorragica virale (VHD), è una forma altamente infettiva e letale di epatite virale che colpisce i conigli europei . Alcuni ceppi virali colpiscono anche lepri e conigli silvilago. I tassi di mortalità generalmente variano dal 70 al 100 percento. La malattia è causata da ceppi di virus della malattia emorragica del coniglio ( RHDV ), un lagovirus della famiglia Caliciviridae .
Virus della malattia emorragica del coniglio
Il virus della malattia emorragica del coniglio (RHDV) è un virus del genere Lagovirus e della famiglia Caliciviridae . È un virus senza involucro con un diametro di circa 35-40 nm, simmetria icosaedrica e un genoma di RNA lineare a senso positivo di 6,4-8,5 kb. RHDV provoca un'infezione generalizzata nei conigli che è caratterizzata da necrosi epatica, coagulazione intravascolare disseminata e morte rapida. La divisione in sierotipi è stata definita dalla mancanza di neutralizzazione incrociata mediante antisieri specifici. I lagovirus del coniglio includono anche calicivirus correlati come il virus della sindrome della lepre bruna europea .
Sembra che RHDV si sia evoluto da un preesistente calicivirus avirulento del coniglio (RCV). Calicivirus di coniglio non patogeni correlati, ma distinti da RHDV, circolavano, apparentemente innocui, in Europa, Australia e Nuova Zelanda prima dell'emergere di RHDV. Nel corso della sua evoluzione RHDV si è diviso in sei genotipi distinti, tutti altamente patogeni.
I tre ceppi di virus della malattia emorragica del coniglio di importanza medica sono RHDV, RHDVa e RHDV2. RHDV (noto anche come RHDV, RHDV1 o come RHD classico) colpisce solo conigli europei adulti ( Oryctolagus cuniculus ). Questo virus è stato segnalato per la prima volta in Cina nel 1984, da cui si è diffuso in gran parte dell'Asia, dell'Europa, dell'Australia e altrove. Alcuni focolai isolati di RHDV si sono verificati negli Stati Uniti e in Messico, ma sono rimasti localizzati e sono stati debellati.
Nel 2010 è stato identificato in Francia un nuovo lagovirus con un profilo antigenico distinto. Il nuovo virus, chiamato virus della malattia emorragica del coniglio 2 (abbreviato come RHDV2 o RHDVb), ha causato anche RHD, ma ha mostrato caratteristiche genetiche, antigeniche e patogene distintive. È importante sottolineare che RHDV2 ha ucciso conigli precedentemente vaccinati con vaccini RHDV e ha colpito giovani conigli europei e lepri ( Lepus spp.). Tutte queste caratteristiche suggeriscono fortemente che il virus non sia derivato da RHDVa, ma da qualche altra fonte sconosciuta. Da allora RHDV2 si è diffuso nella maggior parte dell'Europa, nonché in Australia, Canada e Stati Uniti.
Epidemiologia e trasmissione
Entrambi i virus che causano la RHD sono estremamente contagiosi. La trasmissione avviene per contatto diretto con animali infetti, carcasse, fluidi corporei (urine, feci, secrezioni respiratorie) e capelli. I conigli sopravvissuti possono essere contagiosi fino a 2 mesi. Anche i fomiti contaminati come vestiti, cibo, gabbie, lettiere, mangiatoie e acqua diffondono il virus. Mosche, pulci e zanzare possono trasmettere il virus tra i conigli. I predatori e gli spazzini possono anche diffondere il virus spargendolo nelle loro feci. I calicivirus sono altamente resistenti nell'ambiente e possono sopravvivere al congelamento per periodi prolungati. Il virus può persistere nella carne infetta per mesi e per periodi prolungati nelle carcasse in decomposizione. L'importazione di carne di coniglio può contribuire in modo determinante alla diffusione del virus in nuove regioni geografiche.
Le epidemie di RHD tendono ad essere stagionali nelle popolazioni di conigli selvatici, dove la maggior parte degli adulti è sopravvissuta all'infezione ed è immune. Man mano che i cuccioli crescono e smettono di allattare, non ricevono più gli anticorpi forniti nel latte materno e diventano suscettibili alle infezioni. Pertanto, le epizoozie RHD si verificano più spesso durante la stagione riproduttiva dei conigli.
Generalmente, tra i lagovirus esiste un'elevata specificità dell'ospite. La RHDVa classica colpisce solo i conigli europei, una specie originaria dell'Europa e da cui discende il coniglio domestico. La nuova variante RHDV2 colpisce anche i conigli europei, ma provoca anche una RHD fatale in varie specie di Lepus , tra cui la lepre del Capo sardo ( L. capensis mediterraneus ), la lepre italiana ( L. corsicanus ) e la lepre bianca ( L. timidus ). Segnalazioni di RHD nelle specie Sylvilagus sono arrivate dall'attuale epidemia negli Stati Uniti.
La RHD causata da RHDV e RHDVa dimostra un'elevata morbilità (fino al 100%) e mortalità (40-100%) nei conigli europei adulti. I conigli giovani di 6-8 settimane hanno meno probabilità di essere infettati e i cuccioli di età inferiore a 4 settimane non si ammalano. L'RHDV2 emerso più di recente causa morte e malattie nei conigli di appena 15 giorni. I tassi di mortalità da RHDV2 sono più variabili al 5-70%. Inizialmente meno virulento, la patogenicità di RHDV2 è andata aumentando ed è ora simile a quella riscontrata con RHDV e RHDVa. Morti per RHDV2 sono stati confermati in conigli precedentemente vaccinati contro RHDVa.
Fisiopatologia
Entrambi i ceppi virali di RHDV si replicano nel fegato, causando necrosi epatica e insufficienza epatica, che a loro volta possono portare a coagulazione intravascolare disseminata , encefalopatia epatica e nefrosi . Può verificarsi sanguinamento, poiché i fattori della coagulazione e le piastrine sono esauriti.
Segni clinici
La malattia emorragica del coniglio provoca l'epatite. Il periodo di incubazione per RHDVa è di 1-2 giorni e per RHDV2 3-5 giorni. I conigli infetti da RHDV2 hanno maggiori probabilità di mostrare segni subacuti o cronici rispetto a quelli infetti da RHDVa. Nei conigli è tipica un'epidemia con alti tassi di mortalità nei conigli adulti e subadulti. Se l'epidemia è causata da RHDV2, si verificano decessi anche nei conigli giovani.
La RHD può variare nella frequenza con cui si verificano i segni clinici. Nei casi più acuti, i conigli vengono solitamente trovati morti senza sintomi premonitori. Si possono osservare conigli che pascolano normalmente immediatamente prima della morte.
Nei casi acuti, i conigli sono inattivi e riluttanti a muoversi. Possono sviluppare febbre fino a 42 ° C (107,6 ° F) e aumentare la frequenza cardiaca e respiratoria. Lo scarico di sangue dal naso, dalla bocca o dalla vulva è comune, così come il sangue nelle feci o nelle urine. Prima della morte si possono osservare decubito laterale, coma e convulsioni. I conigli con la forma acuta generalmente muoiono entro 12-36 ore dall'inizio della febbre.
La RHD da subacuta a cronica ha un decorso clinico più protratto ed è più comunemente osservata con le infezioni da RHDV2. I segni clinici comprendono letargia, anoressia, perdita di peso e ittero . Possono anche verificarsi dilatazione gastrointestinale, aritmie cardiache , soffi cardiaci e anomalie neurologiche. La morte, se si verifica, di solito avviene 1-2 settimane dopo l'insorgenza dei sintomi ed è dovuta a insufficienza epatica.
Non tutti i conigli esposti a RHDVa o RHDV2 si ammalano apertamente. Una piccola percentuale di conigli infetti elimina il virus senza sviluppare segni di malattia. Si verificano anche portatori asintomatici e possono continuare a diffondere il virus per mesi, infettando così altri animali. I conigli sopravvissuti sviluppano una forte immunità alla specifica variante virale con cui sono stati infettati.
Diagnosi
Una diagnosi presuntiva di RHD può spesso essere fatta sulla base della presentazione clinica, del modello di infezione all'interno di una popolazione e delle lesioni post mortem . La diagnosi definitiva richiede il rilevamento del virus. Poiché la maggior parte dei calicivirus non può essere coltivata in coltura cellulare, vengono spesso utilizzati metodi molecolari e sierologici di rilevazione virale.
L'emocromo completo di conigli con RHD spesso mostra bassi livelli di globuli bianchi e piastrine e i pannelli di chimica mostrano enzimi epatici elevati. Possono anche essere presenti segni di insufficienza epatica, inclusi aumento degli acidi biliari e della bilirubina e diminuzione del glucosio e del colesterolo. I tempi di protrombina prolungati e di tromboplastina parziale attivata sono tipici. L'analisi delle urine può mostrare bilirubinuria, proteinuria e GGT urinario elevato.
La classica lesione post mortem osservata nei conigli con RHD è un'ampia necrosi epatica e ittero. Inoltre, si possono osservare emorragie multifocali, splenomegalia, broncopolmonite, emorragia o edema polmonare e necrosi miocardica.
Una varietà di test molecolari può essere utilizzata per identificare i virus RHD. I test di reazione a catena della polimerasi a trascrizione inversa sono una modalità di test comunemente usata e accurata per i virus. Altri test utilizzati includono il test di immunoassorbimento enzimatico , la microscopia elettronica , l' immunocolorazione , il Western blot e l' ibridazione in situ . Il tessuto di scelta per i test molecolari è il fegato fresco o congelato, poiché di solito contiene il maggior numero di virus, ma se questo non è disponibile, è possibile utilizzare anche milza e siero. È necessaria l'identificazione del ceppo di RHDV in modo che i protocolli di vaccinazione possano essere adattati di conseguenza.
Prevenzione e controllo
Vaccini
Un certo numero di vaccini disponibili contro la RHD sono venduti nei paesi in cui la malattia è endemica. Tutti forniscono 12 mesi di protezione contro i virus RHD. Poiché i virus RHD normalmente non possono essere coltivati in vitro , il modo in cui vengono prodotti questi vaccini è influenzato. I vaccini RHD inattivati, inclusi Eravac, Felavac e Cylap, sono "derivati dal fegato", il che significa che i conigli di laboratorio sono intenzionalmente infettati con RHD e il loro fegato e milza vengono raccolti per produrre vaccini. Ogni coniglio utilizzato porta alla produzione di migliaia di dosi di vaccino. Ciò ha portato a controversie tra gli amanti dei conigli, che mettono in dubbio l'etica di alcuni conigli che devono morire per proteggere gli altri, ma non è un problema in cui i conigli vengono allevati principalmente per la carne. Un altro metodo per riprodurre il virus è attraverso la tecnologia ricombinante, in cui le porzioni antigeniche dei virus RHD vengono inserite in virus che possono essere coltivati in coltura. Questo è il metodo utilizzato per creare Nobivac Myxo-RHD PLUS.
I vaccini contro solo il classico ceppo RHDVa sono: Cylap RCD Vaccine, prodotto da Zoetis, protegge i conigli da due diversi ceppi di RHDVa (v351 e K5) che vengono utilizzati per il controllo dei conigli selvatici in Australia. CUNIPRAVAC RHD®, prodotto da HIPRA, protegge dai ceppi RHDVa trovati in Europa. Nobivac Myxo-RHD, realizzato da MSD Animal Health, è un vaccino myxoma vettorizzate live che consente una durata di un anno di immunità contro sia RHDVa e mixomatosi .
I vaccini contro solo il nuovo ceppo RHDV2 sono: Il vaccino Eravac, prodotto da HIPRA, protegge i conigli contro RHDV2 per un anno.
I vaccini che proteggono sia dai ceppi RHDVa che RHDV2 includono: Filavac VHD K C+V, prodotto da Filavie, protegge sia contro RHDVa classico che RHDV-2. È disponibile in flaconcini monodose e multidose. Un vaccino di prossima uscita da MSD Animal Health, Nobivac Myxo-RHD PLUS, è un vaccino vettore ricombinante vivo attivo sia contro RHDVa che RHDV2, nonché contro la mixomatosi.
I paesi in cui la RHD non è considerata endemica possono imporre restrizioni all'importazione di vaccini RHDV. L'importazione di questi vaccini negli Stati Uniti può essere effettuata solo con l'approvazione del Dipartimento dell'Agricoltura degli Stati Uniti e del veterinario di stato appropriato.
Disinfezione
I calicivirus sono stabili nell'ambiente e difficili da inattivare. I prodotti comunemente usati per la disinfezione domestica come le salviette disinfettanti Clorox® e Lysol® non funzionano contro questi virus. Un'opzione efficace è quella di pulire le superfici con una soluzione di candeggina al 10% , lasciando 10 minuti di tempo di contatto prima di risciacquare. Altri disinfettanti che hanno dimostrato di funzionare includono idrossido di sodio al 10% , One-Stroke Environ® al 2%, Virkon® S, salviette germicide Clorox® Healthcare Bleach, Trifectant®, Rescue® e detergenti a base di perossido di idrogeno. I detriti superficiali devono essere sempre rimossi meccanicamente prima della disinfezione. Un elenco di disinfettanti efficaci contro il calicivirus (in questo caso il norovirus) è disponibile sul sito Web dell'Agenzia per la protezione dell'ambiente. Gli studi hanno dimostrato che molti disinfettanti a base di composti di ammonio quaternario non inattivano i calicivirus.
Quarantena e altre misure
A causa della natura altamente infettiva della malattia, è necessaria una rigorosa quarantena quando si verificano epidemie. Lo spopolamento, la disinfezione, la vaccinazione, la sorveglianza e la quarantena sono l'unico modo per debellare adeguatamente ed efficacemente la malattia. I conigli deceduti devono essere rimossi immediatamente e gettati in modo sicuro. I conigli sopravvissuti dovrebbero essere messi in quarantena o sottoposti a soppressione umana. I conigli di prova possono essere utilizzati per monitorare il virus negli allevamenti vaccinati.
Distribuzione geografica
La RHD è principalmente una malattia che colpisce i conigli europei, che sono originari della penisola iberica e si trovano allo stato selvatico in gran parte dell'Europa occidentale. Le razze domestiche sono allevate in tutto il mondo per carne e pellicce e stanno diventando animali domestici sempre più popolari. I conigli europei sono stati introdotti e sono diventati selvatici e talvolta invasivi in Australia, Nuova Zelanda, Cile, Argentina e varie isole.
RHD è stato segnalato per la prima volta nel 1984 nella Repubblica popolare cinese. Da allora, la RHD si è diffusa in oltre 40 paesi in Africa, America, Asia, Europa e Oceania ed è endemica nella maggior parte del mondo.
Asia
Il primo focolaio segnalato di RHD causato da RHDVa si è verificato nel 1984 nella provincia cinese di Jiangsu . L'epidemia si è verificata in un gruppo di conigli d' angora importati dalla Germania . La causa della malattia è stata determinata come un piccolo virus a RNA senza involucro. È stato sviluppato un vaccino inattivato che si è dimostrato efficace nella prevenzione delle malattie. In meno di un anno, la malattia si è diffusa su un'area di 50.000 km 2 in Cina e ha ucciso 140 milioni di conigli domestici.
La Corea del Sud è stato il prossimo paese a segnalare focolai di RHD a seguito dell'importazione di pellicce di coniglio dalla Cina. Da allora la RHD si è diffusa ed è diventata endemica in molti paesi dell'Asia, tra cui l'India e il Medio Oriente.
Europa
Dalla Cina, RHDVa si è diffuso verso ovest in Europa. La prima segnalazione di RHD in Europa è arrivata dall'Italia nel 1986. Da lì si è diffusa in gran parte dell'Europa. Il primo caso segnalato in Spagna è stato nel 1988, seguito da Francia, Belgio e Scandinavia nel 1990. La Spagna ha subito una grande moria di conigli selvatici, che a sua volta ha causato un calo della popolazione dei predatori che normalmente mangiavano conigli, tra cui la lince iberica e lo spagnolo aquila imperiale .
La RHD causata da RHDVa è stata segnalata per la prima volta nel Regno Unito nel 1992. Questa epidemia iniziale è stata messa sotto controllo alla fine degli anni '90 utilizzando una combinazione di vaccinazione, rigorosa biosicurezza e buona gestione. Il nuovo ceppo virale RHDV2 è stato rilevato per la prima volta in Inghilterra e Galles nel 2014 e presto si è diffuso in Scozia e Irlanda.
Nel 2010 è emersa in Francia una nuova variante del virus chiamata virus della malattia emorragica del coniglio 2 (RHDV2). Da allora RHDV2 si è diffuso dalla Francia al resto d'Europa, Gran Bretagna, Australia e Nuova Zelanda. Le epidemie hanno iniziato a verificarsi negli Stati Uniti e nell'isola di Vancouver in Canada nel 2019.
La RHD è stata rilevata per la prima volta in Finlandia nel 2016. L'epidemia si è verificata in conigli selvatici europei e i test genetici hanno identificato il ceppo virale come RHDV2. Sono stati confermati casi di trasmissione virale a conigli domestici domestici ed è stata raccomandata la vaccinazione dei conigli.
Oceania
Nel 1991, un ceppo del virus RHDVa, il ceco CAPM 351RHDV, è stato importato in Australia in rigorose condizioni di quarantena per ricercare la sicurezza e l'utilità del virus se fosse usato come agente di controllo biologico contro il problema dei parassiti dell'Australia e della Nuova Zelanda . Il test del virus è stato effettuato sull'isola di Wardang nel Golfo di Spencer, al largo della costa della penisola di Yorke , nell'Australia meridionale . Nel 1995, il virus è sfuggito alla quarantena e successivamente ha ucciso 10 milioni di conigli entro 8 settimane dal suo rilascio. Nel marzo 2017, un nuovo ceppo coreano noto come RHDV K5 è stato rilasciato con successo in modo deliberato dopo quasi un decennio di ricerca. Questo ceppo è stato scelto in parte perché funziona meglio nelle regioni fresche e umide dove il precedente Calicivirus era meno efficace.
Nel luglio 1997, dopo aver esaminato oltre 800 richieste pubbliche, il Ministero della Salute della Nuova Zelanda ha deciso di non consentire l'importazione di RHDVa in Nuova Zelanda per controllare le popolazioni di conigli. Tuttavia, alla fine di agosto, è stato confermato che RHDVa è stato introdotto deliberatamente e illegalmente nell'area di Cromwell nell'Isola del Sud . Un tentativo fallito è stato fatto dai funzionari della Nuova Zelanda per controllare la diffusione della malattia. Tuttavia, si stava diffondendo intenzionalmente e diversi agricoltori (in particolare nell'area del bacino di Mackenzie ) hanno ammesso di trasformare conigli morti a causa della malattia in frullatori da cucina per un'ulteriore diffusione. Se la malattia fosse stata introdotta in un momento migliore, il controllo della popolazione sarebbe stato più efficace, ma è stata rilasciata dopo l'inizio della riproduzione per la stagione e i conigli di età inferiore a 2 settimane al momento dell'introduzione erano resistenti alla malattia. Questi giovani conigli sono stati, quindi, in grado di sopravvivere e riprodurre il numero di conigli. Dieci anni dopo, le popolazioni di conigli (in particolare nel bacino di Mackenzie) stanno iniziando a raggiungere ancora una volta proporzioni prossime alla peste, sebbene non siano ancora tornate ai livelli pre-RHD. La resistenza all'RHD nei conigli della Nuova Zelanda ha portato all'uso diffuso del composto 1080 (fluoroacetato di sodio) . Il governo e il dipartimento della conservazione devono aumentare il loro uso di 1080 per proteggere la terra di riserva dai conigli e preservare i guadagni realizzati negli ultimi anni attraverso l'uso di RHD.
Nord e Sud America
Focolai isolati di RHDVa nei conigli domestici si sono verificati negli Stati Uniti, il primo dei quali in Iowa nel 2000. Nel 2001, si sono verificati focolai in Utah, Illinois e New York. Focolai più recenti di RHDVa si sono verificati nel 2005 in Indiana e nel 2018 in Pennsylvania. Ciascuno di questi focolai era contenuto ed era il risultato di introduzioni separate ma indeterminabili di RHDVa. RHDVa non colpisce il silvilago nativo e le lepri negli Stati Uniti, quindi il virus non è diventato endemico.
La prima segnalazione del virus RHDV2 in Nord America è avvenuta in una fattoria in Québec, nel 2016. Nel 2018 si è verificata un'epidemia più ampia in conigli selvatici europei sul Delta e sull'isola di Vancouver, nella Columbia Britannica. La malattia è stata confermata nello stesso anno in un coniglio domestico in Ohio. Nel luglio 2019, il primo caso di RHDV2 a Washington è stato confermato in un coniglio domestico di Orcas Island . RHDV2 è stato segnalato in conigli domestici a Washington e New York.
Nel 2020, sono stati segnalati focolai della malattia nei conigli domestici, così come nei conigli e nelle lepri silvilago, in Arizona, New Mexico, Colorado, Texas, Nevada, California e Utah. La fauna selvatica colpita include conigli silvilago di montagna ( Sylvilagus nutalli ), conigli silvilago del deserto ( S. audubonii ), lepri antilopi ( L. alleni ) e lepri dalla coda nera ( L. californicus ). Il virus che circola nel sud-ovest degli Stati Uniti è distinto dal RHDV2 isolato da New York, Washington, Ohio e British Columbia, Canada. Le fonti di questi focolai sono sconosciute.
Il Messico ha registrato un focolaio di RHDVa nei conigli domestici dal 1989 al 1991, presumibilmente in seguito all'importazione di carne di coniglio dalla Repubblica popolare cinese. Rigorose misure di quarantena e spopolamento sono state in grado di sradicare il virus e il paese è stato ufficialmente dichiarato privo di RHD nel 1993. Un secondo focolaio di RHD nei conigli domestici è iniziato nello stato di Chihuahua nell'aprile 2020 e da allora si è diffuso a Sonora, Bassa California, Bassa California del Sud, Coahuila e Durango.
Dal 1993, RHDVa è endemico a Cuba. Quattro epizoozie che coinvolgono conigli domestici sono state segnalate nel 1993, 1997, 2000-2001 e 2004-2005. Di conseguenza, migliaia di conigli sono morti o sono stati macellati ogni volta. Si ritiene che il virus sia fiorente anche in Bolivia .
Guarda anche
Riferimenti
- Un nuovo focolaio in Canada ha riportato sull'isola di Vancouver "BC emette avvisi per i proprietari di conigli da compagnia mentre il virus si diffonde nel Lower Mainland | CBC News" .