Na + /K + -ATPasi -Na+/K+-ATPase
| Pompa Na⁺/K⁺-ATPasi | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Pompa sodio-potassio, stato E2-Pi. I confini idrocarburici calcolati del doppio strato lipidico sono mostrati come piani blu (intracellulare) e rosso (extracellulare)
| |||||||||
| Identificatori | |||||||||
| CE n. | 7.2.2.13 | ||||||||
| Banche dati | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Ingresso BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Ingresso KEGG | ||||||||
| MetaCyc | passaggio metabolico | ||||||||
| PRIAM | profilo | ||||||||
| Strutture PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Na⁺/K⁺-ATPasi ( sodio - potassio adenosina trifosfatasi , nota anche come pompa Na⁺/K⁺ o pompa sodio-potassio ) è un enzima ( ATPasi transmembrana elettrogenica ) presente nella membrana di tutte le cellule animali . Svolge diverse funzioni nella fisiologia cellulare .
L'enzima Na⁺/K⁺-ATPasi è attivo (cioè utilizza l'energia dell'ATP ). Per ogni molecola di ATP utilizzata dalla pompa vengono esportati tre ioni sodio e importati due ioni potassio; si ha quindi un'esportazione netta di una singola carica positiva per ciclo di pompaggio.
La pompa sodio-potassio è stata scoperta nel 1957 dallo scienziato danese Jens Christian Skou , premio Nobel per il suo lavoro nel 1997. La sua scoperta ha segnato un importante passo avanti nella comprensione di come gli ioni entrano ed escono dalle cellule e ha un significato particolare per le cellule eccitabili come le cellule nervose , che dipendono da questa pompa per rispondere agli stimoli e trasmettere impulsi.
Tutti i mammiferi hanno quattro diversi sottotipi di pompa del sodio, o isoforme. Ognuno ha proprietà uniche e modelli di espressione dei tessuti. Questo enzima appartiene alla famiglia di ATPasi di tipo P .
Funzione
La Na⁺/K⁺-ATPasi aiuta a mantenere il potenziale di riposo , influenza il trasporto e regola il volume cellulare . Funziona anche come trasduttore/integratore di segnale per regolare la via MAPK , le specie reattive dell'ossigeno (ROS) e il calcio intracellulare. Infatti, tutte le cellule consumano una grande frazione dell'ATP che producono (tipicamente il 30% e fino al 70% nelle cellule nervose) per mantenere le concentrazioni citosoliche di Na e K necessarie. Per i neuroni, la Na⁺/K⁺-ATPasi può essere responsabile fino a 3/4 del dispendio energetico della cellula. In molti tipi di tessuto, il consumo di ATP da parte delle Na⁺/K⁺-ATPasi è stato correlato alla glicolisi . Questo è stato scoperto per la prima volta nei globuli rossi (Schrier, 1966), ma in seguito è stato evidenziato nelle cellule renali, nei muscoli lisci che circondano i vasi sanguigni e nelle cellule cardiache di purkinje. Recentemente, è stato anche dimostrato che la glicolisi è di particolare importanza per Na⁺/K⁺-ATPasi nei muscoli scheletrici, dove l'inibizione della degradazione del glicogeno (un substrato per la glicolisi ) porta a una ridotta attività di Na⁺/K⁺-ATPasi e a una minore produzione di forza. .
Potenziale di riposo

Al fine di mantenere il potenziale della membrana cellulare, le cellule mantengono una bassa concentrazione di ioni sodio e alti livelli di ioni potassio all'interno della cellula ( intracellulare ). Il meccanismo della pompa sodio-potassio sposta 3 ioni sodio fuori e sposta 2 ioni potassio dentro, quindi, in totale, rimuovendo un portatore di carica positiva dallo spazio intracellulare (vedi Meccanismo per i dettagli). Inoltre, c'è un canale di cortocircuito (cioè un canale ionico altamente permeabile al K) per il potassio nella membrana, quindi il voltaggio attraverso la membrana plasmatica è vicino al potenziale di Nernst del potassio.
Potenziale di inversione
Anche se entrambi gli ioni K⁺ e Na⁺ hanno la stessa carica, possono comunque avere potenziali di equilibrio molto diversi per concentrazioni esterne e/o interne. La pompa sodio-potassio si muove verso uno stato di equilibrio con le relative concentrazioni di Na⁺ e K⁺ sia all'interno che all'esterno della cellula. Ad esempio, la concentrazione di K⁺ nel citosol è 100 mM, mentre la concentrazione di Na⁺ è 10 mM. Nello spazio extracellulare, invece, la concentrazione di K⁺ è 5 mM, mentre la concentrazione di Na⁺ è 150 mM.
Trasporto
L'esportazione di sodio dalla cellula fornisce la forza trainante per diversi trasportatori attivi secondari proteine di trasporto di membrana , che importano glucosio , amminoacidi e altri nutrienti nella cellula mediante l'uso del gradiente di sodio.
Un altro compito importante della pompa Na⁺-K⁺ è quello di fornire un gradiente di Na⁺ utilizzato da alcuni processi di trasporto. Nel intestinale , per esempio, sodio viene trasportato fuori dalla cellula riassorbimento del sangue (fluido interstiziale) lato tramite la pompa Na +-K +, mentre, sul lato riassorbire (luminale), il Na +-glucosio symporter utilizza ha creato un gradiente di Na⁺ come fonte di energia per importare sia Na⁺ che glucosio, che è molto più efficiente della semplice diffusione. Processi simili si trovano nel sistema tubulare renale .
Controllo del volume cellulare
Il guasto delle pompe Na⁺-K⁺ può provocare il rigonfiamento della cellula. L' osmolarità di una cellula è la somma delle concentrazioni delle varie specie ioniche e di molte proteine e altri composti organici all'interno della cellula. Quando questa è superiore all'osmolarità all'esterno della cellula, l'acqua scorre nella cellula per osmosi . Ciò può causare il rigonfiamento della cellula e la lisi . La pompa Na⁺-K⁺ aiuta a mantenere le giuste concentrazioni di ioni. Inoltre, quando la cellula inizia a gonfiarsi, questa attiva automaticamente la pompa Na⁺-K⁺ perché modifica le concentrazioni interne di Na⁺-K⁺ a cui la pompa è sensibile.
Funziona come trasduttore di segnale
Nell'ultimo decennio, molti laboratori indipendenti hanno dimostrato che, oltre al classico trasporto di ioni, questa proteina di membrana può anche trasmettere segnali extracellulari di legame all'ouabaina nella cellula attraverso la regolazione della fosforilazione della tirosina proteica. Ad esempio in Ramnanan CJ. 2006, lo studio indaga la funzione di Na+/K+ATPasi nel muscolo del piede e nell'epatopancreas nella lumaca terrestre O.Lactea confrontando gli stati attivo e estivo. Essi hanno concluso che la fosforilazione reversibile può controllare gli stessi mezzi di coordinamento uso ATP da questa pompa ionica con le tariffe della generazione ATP vie cataboliche in estivating O. Lactea .Il segnali a valle attraverso eventi di fosforilazione proteica uabaina-innescato includere attivazione del mitogen- cascate di segnale della proteina chinasi attivata (MAPK), produzione di specie reattive dell'ossigeno mitocondriale (ROS), nonché attivazione del recettore della fosfolipasi C (PLC) e dell'inositolo trifosfato (IP3) ( IP3R ) in diversi compartimenti intracellulari.
Le interazioni proteina-proteina giocano un ruolo molto importante nella trasduzione del segnale mediata dalla pompa Na⁺-K⁺. Ad esempio, la pompa Na⁺-K⁺ interagisce direttamente con Src , una tirosina chinasi non recettoriale, per formare un complesso di recettori di segnalazione. La chinasi Src è inibita dalla pompa Na⁺-K⁺, mentre, al legame dell'ouabaina, il dominio della chinasi Src sarà rilasciato e quindi attivato. Sulla base di questo scenario, NaKtide, un inibitore peptidico Src derivato dalla pompa Na⁺-K⁺, è stato sviluppato come trasduzione del segnale mediata dalla pompa ouabain-Na⁺-K⁺ funzionale. La pompa Na⁺-K⁺ interagisce anche con ankyrin , IP3R, PI3K , PLC-gamma e cofilin .
Controllo degli stati di attività dei neuroni
È stato dimostrato che la pompa Na⁺-K⁺ controlla e imposta la modalità di attività intrinseca dei neuroni cerebellari di Purkinje , delle cellule mitrali accessorie del bulbo olfattivo e probabilmente di altri tipi di neuroni. Ciò suggerisce che la pompa potrebbe non essere semplicemente una molecola omeostatica , "regolatrice" per i gradienti ionici, ma potrebbe essere un elemento di calcolo nel cervelletto e nel cervello . Infatti, una mutazione nella pompa Na⁺-K⁺ causa distonia - parkinsonismo a rapida insorgenza , che presenta sintomi che indicano che si tratta di una patologia della computazione cerebellare. Inoltre, un blocco ouabain di pompe Na⁺-K⁺ nel cervelletto di un topo vivo provoca la visualizzazione di atassia e distonia . L'alcol inibisce le pompe sodio-potassio nel cervelletto e questo è probabilmente il modo in cui corrompe il calcolo cerebellare e la coordinazione corporea. È stato dimostrato che la distribuzione della pompa Na⁺-K⁺ sugli assoni mielinizzati, nel cervello umano, è lungo l'axolemma internodale e non all'interno dell'axolemma nodale come si pensava in precedenza.
Meccanismo
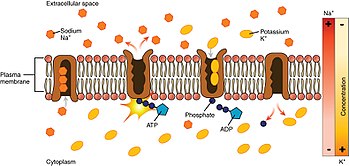
Guardando il processo a partire dall'interno della cellula.
- La pompa ha una maggiore affinità per gli ioni Na⁺ rispetto agli ioni K⁺, quindi, dopo aver legato l' ATP , si lega a 3 ioni Na⁺ intracellulari.
- L'ATP viene idrolizzato , portando alla fosforilazione della pompa in un residuo di aspartato altamente conservato e al successivo rilascio di ADP . Questo processo porta a un cambiamento conformazionale nella pompa.
- Il cambiamento conformazionale espone gli ioni Na⁺ all'esterno. La forma fosforilata della pompa ha una bassa affinità per gli ioni Na⁺, quindi vengono rilasciati; ha invece un'elevata affinità per gli ioni K⁺.
- La pompa lega 2 ioni K⁺ extracellulari. Ciò provoca la defosforilazione della pompa, riportandola al suo precedente stato conformazionale, liberando così gli ioni K⁺ nella cellula.
- La forma non fosforilata della pompa ha una maggiore affinità per gli ioni Na⁺. ATP si lega e il processo ricomincia.
Regolamento
Endogeno
La Na⁺/K⁺-ATPasi è sovraregolata dal cAMP . Pertanto, le sostanze che causano un aumento del cAMP sovraregolano la Na⁺/K⁺-ATPasi. Questi includono i ligandi dei GPCR accoppiati a G s . Al contrario, le sostanze che causano una diminuzione del cAMP sottoregolano la Na⁺/K⁺-ATPasi. Questi includono i ligandi dei GPCR accoppiati a G i . Nota: i primi studi indicavano l' effetto opposto , ma in seguito si è scoperto che questi erano imprecisi a causa di ulteriori fattori di complicazione.
La Na⁺/K⁺-ATPasi è regolata in modo endogeno negativamente dall'inositolo pirofosfato 5-InsP7, una molecola di segnalazione intracellulare generata da IP6K1 , che allevia un dominio autoinibitore di PI3K p85α per guidare l'endocitosi e la degradazione.
Anche la Na⁺/K⁺-ATPasi è regolata dalla fosforilazione reversibile. La ricerca ha dimostrato che negli animali estivi la Na⁺/K⁺-ATPasi è nella forma fosforilata e a bassa attività. La defosforilazione di Na⁺/K⁺-ATPasi può riportarla alla forma ad alta attività.
Esogeno
La Na⁺/K⁺-ATPasi può essere farmacologicamente modificata somministrando farmaci per via esogena. La sua espressione può essere modificata anche attraverso ormoni come la triiodotironina , un ormone tiroideo .
Ad esempio, la Na⁺/K⁺-ATPasi presente nella membrana delle cellule cardiache è un importante bersaglio dei glicosidi cardiaci (ad esempio digossina e ouabaina ), farmaci inotropi utilizzati per migliorare le prestazioni del cuore aumentandone la forza di contrazione.
La contrazione muscolare dipende da una concentrazione intracellulare di Ca²⁺ da 100 a 10.000 volte superiore a quella a riposo , causata dal rilascio di Ca²⁺ dal reticolo sarcoplasmatico delle cellule muscolari. Immediatamente dopo la contrazione muscolare, il Ca²⁺ intracellulare viene rapidamente riportato alla sua normale concentrazione da un enzima trasportatore nella membrana plasmatica e da una pompa di calcio nel reticolo sarcoplasmatico , provocando il rilassamento del muscolo.
Secondo l'ipotesi di Blaustein, questo enzima vettore (scambiatore Na⁺/Ca²⁺, NCX) utilizza il gradiente di Na generato dalla pompa Na⁺-K⁺ per rimuovere Ca²⁺ dallo spazio intracellulare, rallentando così il Na⁺-K La pompa determina un livello permanentemente elevato di Ca²⁺ nel muscolo , che potrebbe essere il meccanismo dell'effetto inotropo a lungo termine dei glicosidi cardiaci come la digossina. Il problema con questa ipotesi è che a concentrazioni farmacologiche di digitale, meno del 5% delle molecole di Na/K-ATPasi, in particolare l'isoforma α2 nel cuore e nella muscolatura liscia arteriosa ( K d = 32 nM), sono inibite, non abbastanza per influenzare la concentrazione intracellulare di Na⁺. Tuttavia, a parte la popolazione di Na/K-ATPasi nella membrana plasmatica, responsabile del trasporto ionico, c'è un'altra popolazione nelle caveole che agisce come recettore della digitale e stimola il recettore dell'EGF .
Regolamento farmacologico
In determinate condizioni, come nel caso di malattie cardiache, potrebbe essere necessario inibire la Na⁺/K⁺-ATPasi tramite mezzi farmacologici. Un inibitore comunemente usato nel trattamento delle malattie cardiache sarebbe la digossina che si lega essenzialmente "alla parte extracellulare dell'enzima cioè che lega il potassio, quando è in uno stato fosforilato, per trasferire il potassio all'interno della cellula". Dopo che si è verificato questo legame essenziale, si verifica una defosforilazione della subunità alfa che riduce l'effetto della malattia cardiaca. È attraverso l'inibizione della Na⁺/K⁺-ATPasi che i livelli di sodio cominceranno ad aumentare all'interno della cellula che alla fine aumenta la concentrazione di calcio intracellulare attraverso lo scambiatore sodio-calcio. Questa maggiore presenza di calcio è ciò che consente di aumentare la forza di contrazione. Nel caso di pazienti in cui il cuore non sta pompando abbastanza forte per fornire ciò che è necessario per il corpo, questo approccio consente il superamento temporaneo di questo.
Scoperta
Na⁺/K⁺-ATPase è stato scoperto da Jens Christian Skou nel 1957 mentre lavorava come assistente professore presso il Dipartimento di Fisiologia, Università di Aarhus , Danimarca . Ha pubblicato il suo lavoro quell'anno.
Nel 1997, ha ricevuto metà del Premio Nobel per la Chimica "per la prima scoperta di un enzima che trasporta ioni, Na⁺,K⁺-ATPasi".
geni
- Alfa: ATP1A1 ATP1A1 , ATP1A2 ATP1A2 , ATP1A3 ATP1A3 , ATP1A4 ATP1A4 . #1 predomina nel rene. #2 è anche conosciuto come "alpha(+)"
- Beta: ATP1B1 ATP1B1 , ATP1B2 , ATP1B3 ATP1B3 , ATP1B4
negli insetti
Gli studi di mutagenesi condotti da Susanne Dobler hanno identificato le forcine M3-M4 e M5-M6 conservate. Nella posizione 312, gli insetti che si nutrono di specie di Apocynum differivano dalla Na⁺/K⁺-ATPasi dei mammiferi per il cambiamento dell'acido glutammico in acido aspartico. Pertanto, è stato scoperto che gli insetti hanno un grado di conservazione più elevato nel C-terminale della tasca di legame dell'ouabaina . Dobler et al. trovato l'87% di identità di amminoacidi tra le sequenze di insetti, che mostra un alto livello di convergenza molecolare tra quattro ordini di insetti erbivori. Pertanto, alcune sostituzioni forniscono resistenza ai cardenolidi come adattamento anche attraverso i rami filogenetici.
Immagini aggiuntive
Guarda anche
Riferimenti
link esterno
- Sodio,+potassio+ATPasi presso la National Library of Medicine Medical Subject Headings (MeSH) degli Stati Uniti
- Banca dati proteica RCSB: pompa sodio-potassio
- Un video di Khan Academy .



